Тема: Валентность химических элементов.
Цель: Ознакомление с понятием «валентность». Определение валентности элементов по формулам их соединений.
задачи обучения: Ввести понятие о «валентности», «бинарное соединение», научить определять валентность по формулам соединений.
задачи воспитания: Воспитывать аккуратность, сосредоточенность, сознательное отношение к процессу обучения, чувство бережного отношения к каждой минуте рабочего времени.
задачи развития: Развивать познавательный интерес, интеллект, формировать положительное отношение к учению, развивать волю, стремление преодолевать познавательные затруднения, правильно оформлять записи в тетрадях, уметь работать с алгоритмами.
Тип урока: Урок усвоения новых знаний.
Методы: Словесный, наглядный, практический.
Оборудование: Таблица валентностей некоторых элементов.
Сабақ барысы / Ход урока
1. Орг. момент. Сообщение темы и целей урока, подготовка учащихся к восприятию новых знаний.
2. Проверка домашнего задания.
![]()
Цифровой диктант
Контроль за выполнением диктанта учащиеся осуществляют методом взаимопроверки.
Задание. Напротив правильных утверждений поставьте цифру 1, напротив неверных – 0.
1. Химический элемент – это определенный вид атомов.
2. В каждой клетке таблицы Д.И.Менделеева, помимо обозначения и названия элемента, записаны два числа: верхнее – относительная атомная масса элемента, нижнее – его порядковый номер.
3. Химический элемент галлий был назван так в честь Франции.
4. В таблице Д.И.Менделеева элементы располагаются, как правило, в порядке убывания их атомных масс.
5. Значения относительной атомной массы и массы атома, выраженной в а. е. м., никогда не совпадают численно.
6. Простыми называют вещества, состоящие из атомов одного элемента.
7. Индекс – это число, показывающее количество взятых частиц (атомов или молекул) вещества.
8. Массовая доля элемента показывает, какую часть (долю) составляет масса данного элемента от всей массы вещества.
9. Относительная молекулярная масса воды Н2О равна 20.
10. Массовая доля кальция в оксиде кальция СаО составляет 71%.
П р а в и л ь н ы е о т в е т ы: 1 – 1, 2 – 0, 3 – 1, 4 – 0, 5 – 0, 6 – 1, 7 – 0, 8 – 1, 9 – 0, 10 – 1.
3. Новый материал.
Валентность
Учитель. Валентность – это способность атомов присоединять к себе определенное число других атомов.
С одним атомом одновалентного элемента соединяется один атом другого одновалентного элемента (HF, NaCl). С атомом двухвалентного элемента соединяются два атома одновалентного (H2O) или один атом двухвалентного (CaO). Значит, валентность элемента можно представить как число, которое показывает, со сколькими атомами одновалентного элемента может соединяться атом данного элемента.
Правила определения валентности элементов в соединениях
![]() Валентность водорода принимают за I (единицу). Тогда в соответствии с формулой воды Н2О к одному атому кислорода присоединено два атома водорода.
Валентность водорода принимают за I (единицу). Тогда в соответствии с формулой воды Н2О к одному атому кислорода присоединено два атома водорода.
![]() Кислород в своих соединениях всегда проявляет валентность II. Поэтому углерод в соединении СО2 (углекислый газ) имеет валентность IV.
Кислород в своих соединениях всегда проявляет валентность II. Поэтому углерод в соединении СО2 (углекислый газ) имеет валентность IV.
Учитель. Как определить валентность элемента, исходя из таблицы Д.И.Менделеева?
У металлов, находящихся в группах а, валентность равна номеру группы.
У неметаллов в основном проявляются две валентности: высшая и низшая (схема).
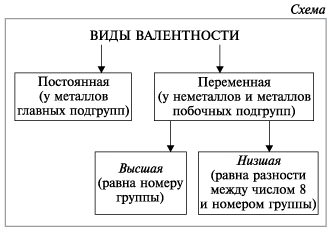
![]() Высшая валентность равна номеру группы.
Высшая валентность равна номеру группы.
![]() Низшая валентность равна разности между числом 8 (количество групп в таблице) и номером группы, в которой находится данный элемент.
Низшая валентность равна разности между числом 8 (количество групп в таблице) и номером группы, в которой находится данный элемент.
Учитель. Например: сера имеет высшую валентность VI и низшую (8 – 6), равную II; фосфор проявляет валентности V и III.
Валентность может быть постоянной (у элементов главных подгрупп таблицы Д.И.Менделеева) или переменной (у элементов побочных подгрупп в таблице), но с этим явлением вы познакомитесь чуть позже, а если интересуетесь, то почитайте учебник 9-го класса.
Валентность элементов необходимо знать, чтобы составлять химические формулы соединений. Для этого удобно воспользоваться следующей таблицей.
Таблица
Алгоритм составления формулы соединения Р и О
| Составление формулы оксида фосфора | |
| 1. Написать символы элементов | Р О |
| 2. Определить валентности элементов | V II |
| 3. Найти наименьшее общее кратное численных значений валентностей | 5•2 = 10 |
| 4. Найти соотношения между атомами элементов путем деления найденного наименьшего кратного на соответствующие валентности элементов | 10 : 5 = 2, 10 : 2 = 5; P : О = 2 : 5 |
| 5. Записать индексы при символах элементов | Р2 О5 |
| 6. Формула соединения (оксида) | Р2О5 |
Учитель. Запомните еще два правила для составления химических формул соединений неметаллов между собой.
1) Низшую валентность проявляет тот элемент, который находится в таблице Д.И.Менделеева правее и выше, а высшую валентность – элемент, расположенный левее и ниже. (Демонстрация таблицы Д.И.Менделеева.)
Например, в соединении с кислородом сера проявляет высшую валентность VI, а кислород – низшую II. Таким образом, формула оксида серы будет SO3.
В соединении кремния с углеродом первый проявляет высшую валентность IV, а второй – низшую IV. Значит, формула – SiC. Это карбид кремния, основа огнеупорных и абразивных материалов.
2) В формулах соединений атом неметалла, проявляющий низшую валентность, всегда стоит на втором месте, а название такого соединения оканчивается на «ид».
Например, СаО – оксид кальция, NaCl – хлорид натрия, PbS – сульфид свинца.
Теперь вы сами можете написать формулы любых соединений металлов с неметаллами.
Самостоятельная работа
Текст работы заранее написан на доске. Двое учащихся решают задание на обратной стороне доски, остальные в тетрадях.
Задание 1. Проверьте, правильно ли написаны формулы следующих соединений: Na2S, KBr, Al2O3,
Mg3N2, MgO.
Задание 2. Напишите формулы соединений металлов с неметаллами: кальция с кислородом, алюминия с хлором, натрия с фосфором. Назовите эти соединения.
После выполнения работы ученики обмениваются тетрадями, происходит взаимопроверка. Учитель может выборочно проверить некоторые тетради, похвалить тех учащихся, которые справились быстрее всех и сделали меньше всего ошибок.
4. Закрепление.
1. Беседа с учащимися по вопросам
1) Что такое валентность?
2) Почему валентность иногда называют атомностью элемента?
3) Чему равны валентности водорода и кислорода?
4) Какие два значения валентности могут проявлять неметаллы?
5) Как определить низшую и высшую валентности неметаллов?
6) Как найти наименьшее общее кратное между численными значениями валентностей?
7) Могут ли атомы в соединении иметь свободные валентности?
8![]() ) Какой из двух неметаллов в химической формуле их соединения занимает 1-е место, а какой –2-е? Поясните на примере оксида NO2, используя таблицу Д.И.Менделеева.
) Какой из двух неметаллов в химической формуле их соединения занимает 1-е место, а какой –2-е? Поясните на примере оксида NO2, используя таблицу Д.И.Менделеева.
1.Выполнение упражнения 3 стр. 34 у доски.
2. Выполнение упражнения 5 стр. 34 у доски.
5![]() . Домашнее задание: § 11 учить, упр. 1,2 (устно), упр. 10 стр. 34 (письм.)
. Домашнее задание: § 11 учить, упр. 1,2 (устно), упр. 10 стр. 34 (письм.)
